Маленькие митохондрии усиливают взаимодействие между нейронами
Нейроны — это клетки с очень необычной формой: от компактного «тела» отходят множественные тонкие отростки — дендриты и аксоны. Оказывается, митохондрии, располагающиеся в дендритах и в аксонах, неодинаковы: в дендритах они сильно удлиненные и протягиваются почти вдоль всей длины отростка, а вот в аксонах они небольшие, многие имеют вид компактных шариков диаметром менее 1 мкм и занимают гораздо меньшее пространство. Ключевым фактором для формирования мелких аксональных митохондрий, как выяснилось, является белок MFF, который необходим для разделения митохондрий. Подавляя активность этого белка, исследователи показали, что нарушение деления митохондрий ослабляет передачу сигналов в синапсах, а также препятствует росту аксонов в процессе развития мозга. Причиной этих нарушений оказалось отнюдь не изменение выработки АТФ (чего можно было бы ожидать, учитывая, что выработка АТФ и считается основной функцией митохондрий), а избыточное откачивание из цитоплазмы ионов кальция. Таким образом, благодаря новому исследованию, опубликованному в Nature Communications, было установлено, что митохондрии в аксонах выполняют буферизующую функцию, поддерживая оптимальную концентрацию ионов кальция в цитоплазме и регулируя передачу сигналов в синапсах.
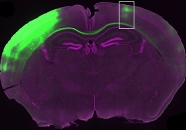
Рис. 1. Пирамидальный нейрон (a) и митохондрии, подсвеченные зеленым в его дендритах (b) и аксонах (с). На графиках показаны линейные размеры митохондрий в аксонах и дендритах (g) и доля длины аксонов и дендритов, которая занята митохондриями (h). In vivo — это данные, полученные на зафиксированных срезах коры головного мозга мышей, в которые предварительно были введены плазмиды белков, избирательно окрашивающих матрикс и митохондрии. In vitro — данные, полученные аналогичным образом в культуре нейронов. Фотография отображает инвертированные цвета, поэтому зеленый флуоресцирующий белок (GFP) здесь выглядит пурпурным, а красный флуоресцирующий белок, окрашивающий митохондрии (mt-DsRED) — зеленым. Рисунок из обсуждаемой статьи в Nature Communications
Нейроны — это клетки, составляющие основные функциональные элементы нервной системы. Структурными элементами нейрона являются тело клетки, в котором располагается ядро с генетическим материалом, и два типа отростков: дендриты(обычно их много, они тонкие и обильно ветвящиеся) и аксон (более толстый отросток, который, однако, обычно тоже ветвится на некотором расстоянии от тела клетки; он всегда один). Оба типа отростков могут формировать множественные контакты с другими клетками, однако функция у них разная: дендриты принимают возбуждающие или тормозящие сигналы от других нейронов и передают их к телу нейрона, а аксон обеспечивает передачу сигналов к следующим нейронам (либо к клеткам мышц).
Передача сигналов от одного нейрона к другому осуществляется через особые образования — синапсы, в которых мембраны передающей и принимающей клеток формируют выпячивания и тесно сближаются друг с другом. Нейроны млекопитающих (таких, как мышь или человек) общаются при помощи химических синапсов. Это значит, что передающий нейрон выделяет через пресинаптическую мембрану сигнальные молекулы — нейромедиаторы, а принимающая клетка улавливает эти молекулы при помощи специальных рецепторов, встроенных в постсинаптическую мембрану. Связывание рецептора с нейромедиатором и вызывает в принимающей клетке те или иные реакции.
Однако в контексте обсуждаемого ниже исследования нам особенно важно рассмотреть то, что происходит в пресинапсической части. Потенциал действия, генерируемый нейроном в ответ на входящие сигналы, распространяется по аксону (в форме токов ионов натрия и калия), достигает терминалей с синапсами и там вызывает открывание кальциевых каналов. Кальций поступает внутрь из межклеточного пространства и активирует белки, встроенные в мембраны синаптических везикул. Благодаря этой активации мембраны везикул сливаются с пресинаптической мембраной, и их содержимое — нейромедиаторы — выбрасывается в синаптическую щель. Таким образом, критическим моментом для передачи сигнала является повышение концентрации кальция в терминали аксона. Весь этот процесс замечательно описан в комиксе «Как происходит выделение нейромедиатора».
Но затем избыток кальция откачивается из цитоплазмы. И тогда активаторный сигнал прекращается до индукции нового потенциала действия.
Работа нейронов очень энергозатратна. Неудивительно поэтому, что митохондрии чрезвычайно важны для их функционирования. Пирамидальные нейроны коры головного мозга содержат огромное количество митохондрий, причем форма этих митохондрий различается в разных частях клетки. В дендритах митохондрии имеют сильно удлиненную форму, напоминая под микроскопом макаронины. В теле клетки такие же удлиненные митохондрии сливаются между собой, формируя густую сеть. Но в аксонах митохондрии выглядят иначе: они гораздо более короткие, многие — практически шарообразной формы. Эти митохондрии без конца снуют туда и обратно, используя в качестве рельсов цитоскелетные элементы — микротрубочки, протянутые вдоль аксона. Эта динамика хорошо видна на видео, снятом в ходе прошлогодней работы польской группы исследователей (T. M. Stępkowski et al., 2017. mitoLUHMES: An Engineered Neuronal Cell Line for the Analysis of the Motility of Mitochondria)
Группа ученых из США, решила продвинуться дальше и разобраться в механизме формирования особенных аксональных митохондрий и в том, есть ли какой-то специфический функциональный смысл в этой их особенности. Их статья на прошлой неделе была опубликована в журнале Nature Communications.
Ученые предположили, что размеры митохондрий могут зависеть от контроля их деления. На сегодняшний день главные молекулярные игроки, задействованные в этом процессе известны (K. Basu et al., 2017. Molecular mechanism of DRP1 assembly studied in vitro by cryo-electron microscopy). Один из этих игроков — белок Mff. Этот белок встраивается в наружную мембрану митохондрий и служит рецептором для моторного белка Drp1. Drp1 формирует кольцо, перетягивающее митохондрию пополам (будто ремнем) и таким образом разделяет ее на две отдельные митохондрии меньшего размера. На рис. 2 показаны и другие молекулы, участвующие в этом процессе. С другой стороны, митохондрии могут и увеличиваться в размере за счет слияния друг с другом, зависящего от другого комплекта белков-регуляторов. В итоге размер и морфология митохондрии определяется, по-видимому, соотношением частоты слияний и разделений.
Рис. 2. Механизм разделения митохондрий при участии Drp1 и MFF рецептора. Рисунок из статьи K. Basu et al., 2017. Molecular mechanism of DRP1 assembly studied in vitro by cryo-electron microscopy
Главным инструментом в руках исследователей стала РНК-интерференция(см. новость У низших животных обнаружены системы управления генами и транспозонами при помощи малых РНК, «Элементы», 03.10.2008). В мышиных нейронах при помощи РНК-интерференции подавляли работу гена Mff, вводя в клетки короткие шпилечные РНК. Контрольные образцы также обрабатывали короткими шпилечными РНК, которые, однако, не должны были влиять на работу каких-либо генов. В итоге было установлено, что при подавлении гена Mff в аксонах действительно стали появляться удлиненные митохондрии. Причем в сумме эти митохондрии стали занимать значительно большую часть внутреннего пространства аксона, чем в контрольных клетках (рис. 3).
Рис. 3. Слияние и деление митохондрий внутри аксона. Здесь показана серия фотографий, зафиксировавших динамику митохондрий на протяжении нескольких минут (время от начала съемки в минутах показано в правом верхнем углу каждого фотоснимка). В клетки ввели плазмиду с геном белка mt-mEos2, который метит митохондрии, встраиваясь в их мембраны. Облучая небольшую зону аксона светом определенной волны, получали фотоконверсию, из-за которой меняется спектр флуоресценции репортерного белка. На данных фото митохондрии без фотоконверсии выглядят зелеными, а с фотоконверсией — пурпурными. Спустя время некоторые митохондрии сливаются и в результате смешения цветов выглядят белесоватыми. Верхняя серия фотографий демонстрирует нормальный процесс слияния-деления митохондрий в аксоне контрольных клеток. Несмотря на наличие обоих процессов, митохондрии остаются короткими. Нижняя серия показывает результаты аналогичного исследования для нейронов с подавленным Mff (при помощи коротких шпилечных РНК — Mff shRNA). Здесь преобладает слияние, и митохондрии со временем удлиняются. Рисунок из обсуждаемой статьи в Nature Communications
Сделав видеозаписи изменения митохондрий, помеченных флуоресцентными красителями, в клетках с интерференцией и без интерференции гена Mff (видео 1, видео 2, видео 3), исследователи убедились, что причиной наблюдаемых изменений стало значительное уменьшение частоты делений митохондрий и некоторое повышение частоты их слияний. При подавленном гене Mff уже на входе в аксон оказывались более длинные митохондрии, чем при нормально работающем Mff. Соотношение же частоты разделений и слияний митохондрий внутри самого аксона при подавлении Mff снизилось более чем в 3 раза. Фото, сделанные во время одного из подобных экспериментов, приведены на рис. 3. Чтобы застраховаться от возможных ошибок в интерпретации результатов, проводили также эксперименты, в которых наряду со шпилечными РНК против Mff вводилась «спасительная» копия самого Mff гена. Фенотип аксональных митохондрий в этом случае восстанавливался — и это подтверждает, что наблюдаемые эффекты не связаны с какими-то неспецифическими влияниями производимых над клетками манипуляций.
Функциональное значение слияния и деления митохондрий обычно объясняют с двух точек зрения. Во-первых, энергетическая эффективность маленьких митохондрий оказывается несколько ниже, чем у больших — просто вследствие большей утечки протонов из-за более высокой суммарной площади поверхности по отношению к объему. Соответственно, митохондрии более склонны сливаться при голодании, а при избытке питательных веществ дробятся на более мелкие. Во-вторых, деление митохондрий позволяет сегрегировать «высококачественные» митохондрии, выполняющие свои функции как следует, от дефектных, которые функционируют хуже вследствие поломок в геноме или по иным причинам — такие митохондрии подвергаются уничтожению при помощи системы аутофагии. Но поскольку в данном случае морфология митохондрий оказывается специфичной для клеточных компартментов, ни одно из изложенных объяснений не кажется удовлетворительным.
Быть может размер митохондрий отрицательно сказывается на их мобильности внутри аксона или на возможности захвата митохондрий в пресинаптическую область? Ученые измерили соответствующие показатели в клетках с нормальным и подавленным Mff, сравнили результаты — это предположение не подтвердилось.
Далее измерили электрохимический потенциал на мембране митохондрий, окислительно-восстановительный потенциал матрикса, скорость синтеза АТФ длинными и короткими митохондриями в аксонах экспериментальных клеток (кому интересно как именно — рекомендую обратиться к оригинальной статье, но все использованные подходы так или иначе опираются на явление флуоресценции), сравнили, и снова не выявили значимых различий.
Наконец, решили проверить, не влияют ли митохондрии каким-то образом на динамику ионов кальция. Напомню, что именно поступление избыточного кальция в терминали аксона заставляет нейрон высвободить нейромедиатор, отправляя сигналы к принимающей клетке. Куда этот избыточный кальций уходит потом? Частично снова выводится наружу, часть захватывается трубочками эндоплазматической сети, и еще какая-то часть поглощается митохондриями (это было установлено авторами в работе, опубликованной ранее). Может быть именно здесь и кроется ключ к ответу? Эту гипотезу проверяли, замеряя уровни кальция в аксонах пирамидальных нейронов коры головного мозга мышей до, во время и после индукции потенциалов действия. Выяснили следующее:
1) Суммарное количество ионов кальция, удерживаемого внутри длинных митохондрий в состоянии покоя выше, чем в коротких митохондриях. Это и логично, учитывая больший объем матрикса в первых по сравнению со вторыми.
2) Немедленно после индукции потенциала действия кальций, поступивший внутрь терминали аксона, быстрее откачивается близлежащими крупными митохондриями, чем мелкими. В итоге концентрация ионов кальция в цитоплазме внутри терминали оказывается в первом случае более низкой, чем в норме при мелких митохондриях.
3) В присутствии длинных митохондрий в синаптическую щель выделяется меньше нейромедиатора, следовательно, к принимающей клетке приходит ослабленный сигнал по сравнению с тем, что происходит в случае контрольных нейронов с мелкими аксональными митохондриями. Это, собственно, вполне ожидаемое следствие более низкого уровня ионов кальция в цитоплазме.
Рис. 4. Активность Mff существенна для формирования ветвлений аксонов пирамидальных нейронов в ходе развития коры головного мозга. В левой частирисунка — полные срезы мозга мыши. Зеленым светятся зоны расположения нейронов и их отростков, в которые на эмбриональной стадии развития при помощи электропорации вводили указанные по левому краю конструкции. Самый верхний срез (a) — контрольный образец, ниже (d) — образец с подавленным геном Mff, в самом низу (g) — образец, где проводилось введение шпилечной РНК против гена Mff одновременно со «спасительной» копией того же гена. Во всех случаях конструкции вводились в левую половину мозга (здесь мы видим ярко-зеленое свечение), но отростки нейронов, расположенных в этой области, тянутся к противоположному полушарию, где их отростки формируют светло-зеленые «облачка». Зоны с этими «облачками» выделены прямоугольниками и показаны правее в большем увеличении. Можно заметить, что в мозге с подавленным Mff эти «облачка» заметно слабее, особенно верхнее, заходящее в слой, обозначенный как L2/3 — это указывает на уменьшение ветвления терминалей аксонов. Рисунок из обсуждаемой статьи в Nature Communications
Кроме того исследователи проверили и влияние размера митохондрий на развитие коры головного мозга. Для этого в определенную область коры головного мозга мышиных эмбрионов (на 15-й день жизни) вводили шпилечные РНК (контрольные или интерферирующие ген Mff). Одновременно вводили ген флуоресцирующего белка для последующей визуализации. Образцы срезов мозга получали через три недели после рождения мышат. В контрольных образцах аксоны от пирамидальных нейронов соответствующей области направлялись в противоположное полушарие и там формировали две зоны обильного ветвления: в слое 2/3 и в слое 5 коры головного мозга. Но это ветвление было значительно слабее (особенно в слое 2/3) в случае, когда Mff был подавлен. Между тем «спасительная» копия гена Mff частично восстанавливала ветвление, так что картина получалась более близка к норме (рис. 4).
Общая картина, вырисовавшаяся по итогам этого исследования, отражена на рис. 5.
Рис. 5. Общая схема влияния размера митохондрий, контролируемого Mff, на функции и морфологию нейрона. В контрольных нейронах в аксон входят небольшие митохондрии и их размер поддерживается при перемещении вдоль аксона благодаря балансу между процессами слияния и деления митохондрий (a). Потеря активности Mff приводит к увеличению размера митохондрий, входящих в аксон, а также к сокращению частоты делений по сравнению с частотой слияний митохондрий (b). В итоге размеры митохондрий увеличиваются, а ветвление аксона уменьшается. В контрольных нейронах около 50% пресинаптических расширений («бутонов») содержит вблизи небольшую митохондрию (c). При активации нейрона, митохондрия буферизует некоторое количество поступившего Ca2+, вследствие чего здесь высвобождается меньше нейромедиаторов, чем в «бутонах» без митохондрии. При подавлении Mff, увеличенные митохондрии захватывают больше кальция из цитоплазмы, что значительно уменьшает выброс нейромедиатора в синаптическую щель (d). Вероятнее всего, именно это и приводит в конечном итоге к уменьшению ветвления аксона, поскольку активация синапсов служит поддерживающим стимулом для инициации ветвления по механизму обратной связи. Рисунок из обсуждаемой статьи в Nature Communications
Итак, обсуждаемая работа выявила еще одну важную функцию митохондрий в качестве регулятора уровня кальция в нейронах. Вместе с тем картина не ясна в полной мере. К примеру, остается вопрос, каким образом обеспечивается формирование морфологически разных митохондрий в дендритах и в аксонах одних и тех же нейронов (между прочим, напоминают авторы, движение митохондрий, располагающихся внутри аксонов и внутри дендритов обеспечивается двумя разными моторными белками: TRAK1 и TRAK2, соответственно — может ответ где-то тут)? И как их функция в качестве депо кальция задействована (если задействована) в дендритах? Что ж, будем ждать продолжения. Авторы представленного исследования наверняка не остановятся на достигнутом.
Татьяна Романовская
Источник: Элементы










Добавьте свой комментарий