Исследование устойчивости грибов к лекарственным препаратам
Биологи из МГУ имени М.В.Ломоносова выяснили механизмы, из-за которых патогенные грибы приобретают устойчивость к лекарственным препаратам. Чтобы понять, как устроена система защиты грибов от токсинов, учёные использовали пекарские дрожжи с химерными светящимися белками, необходимыми для защиты. Учёные пытались обмануть защитные механизмы дрожжей, «спрятав» токсичное соединение в митохондриях. Обойти защиту клетки таким образом не удалось: дрожжи «чувствовали» даже адресованные в митохондрии вещества и активировали систему защиты как ни в чём не бывало. Исследование показало, что устойчивость дрожжей (и, возможно, патогенных грибов) к антимикотикам устроена сложнее, чем считалось прежде. Работа проходила в рамках направления «Микроорганизмы и грибы» проекта «Ноев ковчег» (при поддержке Российского научного фонда), её результаты опубликованы в журнале Scientific Reports.
Устойчивость патогенных микроорганизмов к лекарствам — серьёзная медицинская проблема. Наиболее известны «супербактерии», устойчивые к антибиотикам, но некоторые патогенные грибы тоже приобрели механизмы защиты от антигрибковых препаратов — антимикотиков. Один из таких механизмов — сверхактивация АВС-переносчиков. Такие белки-переносчики находятся в мембране клетки гриба и выбрасывают потенциально опасные вещества из цитоплазмы.
У грибов со множественной лекарственной устойчивостью, в том числе болезнетворных, АВС-переносчики выбрасывают из клетки разные виды антимикотиков, и эффективность лечения от грибковых инфекций существенно снижается. В 2016 году исследовательская группа НИИ физико-химической биологии имени А.Н. Белозерского МГУ описала способ подавления множественной лекарственной устойчивости у грибов. Учёные «обманули» защитный механизм дрожжевых клеток с помощью относительно безвредных для микроорганизмов соединений – алкил-родаминов. Эти вещества, как и другие липофильные катионы (умеренно растворимые в воде положительно заряженные ионы), легко проникают через клеточные мембраны. Кроме того, алкил-родамины светятся при облучении и потому часто используются в исследованиях как флуоресцентные красители.
Алкил-родамины загружали бессмысленной работой АВС-переносчики: вместо того чтобы выбрасывать из клетки токсичные для гриба антимикотики, они откачивали красители. Химические свойства липофильных катионов таковы, что, выброшенные из клетки, они тут же возвращаются. В результате большая часть АВС-переносчиков в мембране была занята перекачиванием безвредных красителей, а противогрибковый препарат, добавленный одновременно с алкил-родаминами, накапливался в цитоплазме.
«Когда в клетке повышается концентрация чужеродных веществ, она запускает компенсаторный ответ — начинает производить больше АВС-переносчиков, чтобы быстрее выкачивать потенциально опасные соединения, — поясняет один из авторов работы, старший научный сотрудник НИИ физико-химической биологии имени А.Н. Белозерского МГУ Дмитрий Кнорре. — Мы предполагали, что липофильные катионы не вызовут компенсаторного ответа. Дело в том, что благодаря своему положительному заряду они проникают в отрицательно заряженные органеллы клетки — митохондрии — и накапливаются там. То есть в цитоплазме клетки, обработанной липофильными катионами, не будет значительной концентрации этих веществ. А сенсорные системы грибов, как нам было известно, улавливают чужеродные соединения в цитоплазме. Наш расчёт состоял в том, что в митохондриях клетка не обнаружит посторонние вещества, и сверхактивации АВС-переносчиков не произойдёт».
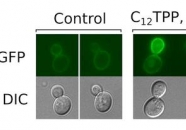
Чтобы проверить эту гипотезу, исследователи добавили к культуре пекарских дрожжей один из липофильных катионов додецилтрифенилфосфоний (С12ТРР). Обычные дрожжи, которые используются в кулинарии, часто служат модельным объектом для изучения молекулярных механизмов грибов. Для удобства исследования учёные создали химерный белок: одна его часть оставалась такой же, как основной АВС-переносчик у грибов, а вторая представляла собой зелёный флуоресцентный белок. Под облучением такое соединение интенсивно светится, и за его накоплением в клетках можно наблюдать в флуоресцентный микроскоп. Остальные свойства химерного белка не изменились, и в клетке он выполнял функцию АВС-переносчика.
Результаты исследования показали, что взаимодействие с липофильными катионами всё же заставляет клетки дрожжей запускать компенсаторный ответ. В присутствии липофильных катионов дрожжи производили и накапливали заметно больше АВС-переносчиков, чем в обычных условиях. Другие методы также показали увеличение лекарственной резистентности под действием липофильных катионов. Пока неизвестен механизм, который позволяет клетке обнаружить чужеродные соединения в митохондриях. Вероятно, одновременно в ней работает несколько взаимодополняющих систем, реагирующих на потенциально опасные вещества. Реальные принципы их работы ещё предстоит изучить. Авторы планируют проводить будущие исследования как на культуре пекарских дрожжей, так и на патогенных видах грибов.
В работе над исследованием участвовали научные сотрудники факультета биоинженерии и биоинформатики МГУ, НИИ физико-химической биологии имени А.Н. Белозерского и Института молекулярной медицины ПМГМУ имени И.М. Сеченова.
Фото: Клетки дрожжей, нарабатывающие химерный белок Pdr5-GFP, под флуоресцентным микроскопом. Часть белка Pdr5 соответствует главному АВС-переносчику дрожжей, GFP — это зелёный флуоресцентный белок, обеспечивающий свечение. Видно, что в клетках, обработанных ли





Добавьте свой комментарий