Ученые выяснили, в каких условиях в организме возрастает количество опасного для ДНК кислорода
Международная группа ученых при участии исследовательницы из МГУ имени М.В.Ломоносова показала, в каких условиях в организме выделяется больше супероксида — опасной формы кислорода, способной разрушать ДНК. Статья была опубликована в журнале Free Radical Biology and Medicine.
У людей мутации в гене, кодирующем белок DHTKD1, сопутствуют многим неврологическим заболеваниям, а на молекулярном уровне — накоплению продуктов распада аминокислот лизина и триптофана и свободных радикалов. Структура белка DHTKD1 похожа на структуру фермента 2-оксоглутаратдегидрогеназы, который может производить супероксид — опасную форму кислорода, способную разрушать ДНК. Международная группа ученых при участии ведущего научного сотрудника НИИ ФХБ имени А.Н. Белозерского МГУ имени М.В.Ломоносова, доцента факультета биоинженерии и биоинформатики МГУ имени М.В.Ломоносова, д.х.н. Виктории Буник показала, в каких условиях возрастает продукция супероксида за счет белка DHTKD1. По словам исследовательницы, дальнейшее изучение белка DHTKD1 позволит разработать методы лечения пациентов с мутациями гена, кодирующего этот белок.
Клеточная АЭС
Митохондрии часто сравнивают с электростанциями внутри клетки. Их топливо — жирные кислоты и пируват (остаток пировиноградной кислоты), благодаря которому на выходе получается АТФ — «вещество-батарейка», универсальный источник энергии для всех внутриклеточных процессов. Как и наши атомные электростанции, митохондрия сложна в эксплуатации, взаимодействует с опасными для организма веществами и образует отходы — свободные радикалы (химические соединения, содержащие на внешней оболочке электрон или несколько электронов без пары, и потому обладающие отрицательным зарядом и очень активные). К ним относится супероксид — токсичная форма кислорода, которая при накоплении в большом количестве способна повреждать ДНК, вызывая мутации, и нарушать слаженную работу ансамбля других химических реакций, «ломая дирижерские палочки» управляющих ими ферментов. Борется клетка с «ядовитыми» формами кислорода с помощью антиоксидантов (веществ, препятствующих окислению), и белков системы антиоксидантной защиты (например, супероксиддисмутазы).
Два брата-адипата
Нехватка аминокислот может снижать синтез ферментов (белков, ускоряющих конкретные химические реакции в организме). Так, недостаток аминокислот (кирпичиков для строительства белков) лизина и триптофана может вызывать физические, неврологические и умственные расстройства и даже привести к летальному исходу. Эти аминокислоты относятся к незаменимым и синтезироваться в организме человека из других веществ не могут, поэтому должны поступать с пищей.
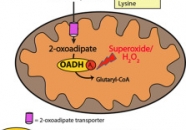
2-аминоадипат и 2-оксоадипат — вещества, образующиеся при расщеплении лизина, триптофана и гидроксилизина (точнее, их L-форм, закрученных влево, — в таком виде существуют почти все аминокислоты, входящие в состав белков).
Недавно ученые нашли связь ацидурии (повышенной кислотности мочи, указывающей на тяжелые нарушения обмена веществ) у пациентов с повышенным содержанием в моче 2-аминоадипата и 2-оксоадипата с мутациями в белке DHTKD1. Это подтверждает обоснованную исследователями из МГУ (Bunik & Degtyarev, 2008) ранее гипотезу, что белок-фермент, закодированный в DHTKD1, окисляет 2-оксоадипат. У некоторых пациентов высокие уровни 2-аминоадипата и 2-оксоадипата тяжело диагностировать, и расстройства протекают без симптомов. Поэтому связать конкретные мутации с заболеваниями не получается.
Белок DHTKD1 в большом количестве производится в клетках печени и почек, где активно расщепляются лизин и триптофан, а у людей — и в скелетных мышцах. Как подавление, так и усиление активности гена, ответственного за производство этого белка, повышает уровень реактивных, опасных форм кислорода.
Путь длиной в десятилетия
Ученый из МГУ, доктор химических наук Виктория Буник была привлечена к данной работе в качестве известного международного эксперта по полиферментным комплексам дегидрогеназ 2-оксокислот (к которым относится уже упомянутая нами 2-оксоглутаратдегидрогеназа, на которую похож белок DHTKD1) и катализируемым ими побочным реакциям генерации активных форм кислорода. В 2003 году Виктория Буник опубликовала обзор собственных работ по механизму таких побочных реакций, а в 2008 году — работу, предсказывающую существование у млекопитающих одного из таких комплексов, не известного ранее.
Экспериментальному исследованию катализируемой этим новым комплексом генерации активных форм кислорода и была посвящена опубликованная вместе с американскими коллегами из Института исследований старения Бака (Калифорния, США) работа.
В ходе работы использовались биохимические методы исследования митохондрий, метод регистрации производства митохондриями перекиси водорода с помощью создания флуоресцирующего (светящегося) соединения. Было установлено, что продукция супероксида возрастает при высоких концентрациях 2-оксоадипата, а также выяснено, что супероксид образуется именно при окислении 2-оксоадипата.
«Помимо решения конкретных задач по характеристике источников генерации вредных побочных продуктов жизнедеятельности, научная ценность работы состоит в демонстрации существующего уровня понимания живых систем, достигнутого в фундаментальных исследованиях. В данном случае такой уровень позволил не только интерпретировать содержащуюся в геноме информацию с точки зрения биохимических функций, но и правильно предсказать поведение биохимической системы (митохондрий) в тех или иных экспериментальных условиях», — комментирует результаты работы Виктория Буник.
«В настоящее время работа по характеристике этого нового комплекса в МГУ продолжается в связи с обнаруженными у человека мутациями. В частности, совместно с Медико-генетическим научным центром в Москве мы исследуем функцию данного белка при мутациях его гена с целью разработки не известных на данный момент методов лечения таких пациентов», — заключает ученый.





Добавьте свой комментарий