Наномицеллы сработали против рака легкого
- 800 просмотров
Ученые под руководством профессора химического факультета МГУ и Университета Северной Каролины Александра Кабанова исследовали действие наномицелл противовирусного препарата резикимод против злокачественной опухоли легких. Испытания на лабораторных мышах показали эффективность резикимода по сравнению с альтернативными видами терапии. Результаты исследования опубликованы в журнале Science Advances.
Мелкоклеточный рак легкого (НМРЛ) – самое распространенное злокачественное новообразование легких (от 80 до 85% случаев рака легких) и причина большинства смертей от рака во всем мире. Послеоперационный рецидив и метастазирование вызывают гибель в значительном проценте случаев НМРЛ.
Развитие опухолей обеспечивают несколько механизмов защиты от иммунной системы организма. Programmed cell death-1 (PD-1) – рецептор, играющий ключевую роль в толерантности Т-клеток иммунной системы к нормальным клеткам организма. Для обмана иммунитета онкоклетки активно экспрессируют лиганд PD-L1, который связывается с PD-1 и выключает атаку T-клеток на раковую опухоль. Управление по надзору за пищевыми продуктами и медикаментами CША (Food and Drug Administration, FDA) одобрило лечение НРМЛ с помощью ингибиторов PD-1/PD-L1, однако большинству пациентов с НРМЛ такая терапия не помогает.
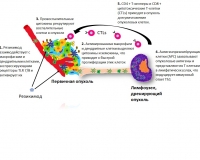
Взломать защиту опухолевых клеток можно другим способом. Мембранные толл-подобные рецепторы (toll-like receprots – TLR) в клетках выполняют роль сигнализации, которая поднимает по тревоге иммунную систему и активирует выработку цитокинов, борющихся с патогенными макрофагами. Более десятка обнаруженных толл-подобных рецепторов млекопитающих (TLR1–TLR13) содержатся в различных клетках. Для раковых клеток патогенами являются защитные T-клетки организма. Во многих опухолях до половины массы приходится на клетки-макрофаги, подавляющие противоопухолевый иммунный ответ. Вместе с тем макрофаги – ненадежные защитники для раковых клеток, их можно «перевербовать», если воздействовать на их рецепторы TLR. Если переключить TLR опухолевых макрофагов, их можно превратить в противовоспалительный тип макрофагов, которые пропускают в опухоль T-клетки.
Пока в онкотерапии применяют только один препарат-антагонист TLR7 имиквимод – крем для лечения поверхностного базальноклеточного рака и бородавок. Плохая растворимость низкомолекулярных антагонистов TLR в воде снижает их эффективность в качестве противоопухолевых препаратов. В виде наночастиц, не превышающих 100 нм, антагонисты TLR можно адресно доставить в опухоли. Сотрудники Университета Северной Каролины в Чапел-Хилле (США) под руководством профессора кафедры химической энзимологии химического факультета МГУ и Университета Северной Каролины, члена-корреспондента РАН Александра Кабанова синтезировали наномицеллы препарата резикимод и проверили его противоопухолевую активность на лабораторных мышах.
«Наша система отличается максимальной простотой и опирается на принцип полимерных мицелл, который более 30 лет назад я начинал разрабатывать с коллегами, еще работая в СССР – в Институте прикладной молекулярной биологии и на химическом факультете МГУ имени М.В. Ломоносова. Современная технология полимерных мицелл сверхвысокой загрузки, которую мы использовали, хотя еще не испытывается на людях, к этому максимально приспособлена», – рассказал профессор Кабанов.
Резикимод, антагонист TLR7 и TLR8, был разработан как стимулятор противовирусного иммунного ответа. Однако он оказался слишком активным и вызывал гриппоподобный симптом сродни цитокиновому шторму, о котором сейчас широко известно благодаря COVID-19. Из-за побочных эффектов резикимод не стали использовать для лечения вирусных заболеваний. Однако подобные побочные эффекты хорошо изучены в иммунотерапии рака, поэтому российские и американские ученые решили попробовать этот препарат против НМРЛ.
Ученые показали, что резикимод снижает рост опухоли и многократно увеличивает продолжительность жизни больных животных, чего не наблюдается в случае ингибитора PD-1. Медиана выживаемости у больных животных, которым давали резикимод, более чем в два раза превышала выживаемость у группы, которую лечили ингибитором PD-1. Обычные химиотерапевтические препараты против таких опухолей бессильны.
«Важно отметить, что из-за сильных побочных эффектов резикимод вряд ли станет терапевтическим противоопухолевым препаратом. Однако принцип лечения с помощью наномицелл, меняющих T-клеточный ответ окружения опухоли, перспективен как форма лечения рака», – подчеркнул Александр Кабанов.
Иллюстрация. Александр Кабанов/МГУ


Добавьте свой комментарий